Суверенизация фармации — плюсы и минусы (ч. 5)
Клинические испытания (КИ) — ключ к замку, открывающему дверь в пространство фармакотерапии, где удачный и профессиональный дизайн вознаграждает участников — пациентов, их родных и близких, компании–разработчики, экономику, социум. Это код доступа в мир лекарств, занимающих в науке о жизни, здравоохранении и менталитете современного общества все большее место.
Гандель Виктор Генрихович
Член-корр. Международной академии интеграции науки и бизнеса (МАИНБ), к.фарм.н.
"Ни одну проблему нельзя решить на том уровне сознания, на котором она была создана"
Альберт Эйнштейн, физик-теоретик, лауреат Нобелевской премии
Для целей суверенизации фармации КИ представляют особую ценность, являясь, по существу, ее фундаментальной, если хотите, философской основой. Кратко оценим то, что у нас было потеряно, что удалось сохранить, какие инновации внедрены.
Советский период
Советский период создания и развития контрольно–разрешительной системы (КРС), ставшей регуляторной основой КИ, базировался на завоевавшем мировое признание государственном социалистическом здравоохранении, названном в честь его создателя "системой Семашко" (по имени Наркома здравоохранения СССР акад. Н.А. Семашко).
На ее базе была выстроена модель КИ, оформленная как Всесоюзный научный центр экспертизы лекарственных средств (ВНЦЭЛС МЗ СССР), ныне ФГУ "Научный центр экспертизы средств медицинского применения" Минздрава России (ФГУ "НЦЭСМП" МЗ России). Наряду с Фармакопейным и Фармакологическим комитетами это обеспечивало надлежащий контроль качества проводимых исследований и создаваемых ЛП.
В стране сформировалась характерная для государства с плановой экономикой иерархия КИ, развитие которой протекало в рамках социалистической системы хозяйствования с лимитированным финансированием. Успехи достигались качеством медицинской науки и образования, преданностью профессии, компетентностью организаторов и исполнителей, подготовленностью клинической базы, обменом опытом в рамках стран СЭВ.
Разбалансированность экономики к концу советского периода, вызванная перестройкой и радикальными "реформами", свела многие достижения на нет.
Упадок и восстановление
Становление рыночного хозяйства в стране началось с создания страховой медицины и упразднения Минздрава СССР, что не только приостановило решение проблемы разработки безопасных и эффективных лекпрепаратов в новой России, но и отбросило отечественное здравоохранение в этой области на много позиций назад.
Медработники и население перестали получать независимую, объективную и всестороннюю информацию о лекпрепаратах: безопасности применения, осложнениях фармакотерапии, мерах профилактики.
Популярная в этот период политика "открытых дверей" и "свободного фармацевтического рынка" привела к непредсказуемому увеличению количества регистрируемых и поступающих в обращение ЛП, что потребовало усиления контроля над процедурами регистрации лекарств и изучения их побочного действия.
На НЦЭСМП "обрушилась" непосильная, как тогда казалось, задача восстановить былой потенциал КРС, нарастить его до уровня требований рыночной фармакоэкономики, вернуть доверие граждан лекарственной политике страны.
Благодаря компетенции сотрудников Центра, к завершению нулевых годов удалось не только вернуть прежний функционал, но и "добавить" компетенции до высоты планки международных требований, что было оценено ВОЗ: в октябре 1997 г. Россия была утверждена в качестве постоянного члена Программы по международному мониторингу лекарств и получила прямой доступ к уникальной базе данных ВОЗ по побочным действиям лекарственных средств.
С принятием в 1998 г. Закона "О лекарственных средствах" (впоследствии ФЗ-61, последняя ред. от 08.03.2022), согласно которому Минздраву РФ были переданы функции федерального органа, регулирующего лекарственное обращение в стране, ведомственные организации КРС были объединены под эгидой НЦЭСМП, что обеспечило совершенствование экспертизы и контроля качества как отечественных, так и зарубежных лексредств.
Восстановили КРС ведущие ученые медико–фармацевтического дела, опытные специалисты и организаторы: акад. РАН В.П. Фисенко, акад. РАН и РАСХН Р.В. Петров, проф. В.Б. Герасимов, проф. А.Н. Миронов, д.м.н. Ю.В. Олефир, к.м.н. С.В. Буданов и к.м.н. В.В. Косенко и др.
В 1996 г. стандарт, в соответствии с которым проводились КИ, был кодифицирован Международной конференцией по гармонизации (ICH) как "надлежащая клиническая практика" (ICH-GCP), официально опубликован под эгидой ВОЗ и акцептированРоссией как ГОСТ Р 52379-2005 (дата актуализации — 06.04.2015). Соблюдение данного стандарта служит гарантией прав, безопасности и благополучия субъектов КИ в соответствии с принципами Хельсинкской декларацией, а также достоверности полученных данных.
В соответствии с указанным документом сотни отечественных и зарубежных фармацевтических продуктов были апробированы и нашли свое место на аптечных полках.
Можно смело констатировать, что к нулевым годам КИ в России заняли достойное место в этом медико–фармацевтическом разделе мирового здравоохранения, что привлекло в нашу страну ведущих спонсоров–исследователей фармакологических продуктов и ЛП.
КИ проводились в основном по следующим основаниям:
- в рамках процесса регистрации нового лекарственного средства с целью вывода в обращение;
- в рамках международного многостранового исследования (не для целей регистрации);
- для регистрации у ЛП новых показаний.
По данным контрактно–исследовательской организации (CRO) Synergy Research Group, доля международных многоцентровых исследований в период 1997-2007 гг. увеличилась с 35 до 66% — отличный показатель для развивающегося рынка КИ.[1]
За последние 10 лет только в Москве выполнено свыше 1700 КИ, примерно 60 медорганизаций готовы проводить исследования в более 50 терапевтических областях.[2]
Период 2010-х годов вообще стал наиболее благоприятным для проведения КИ, как для нашей страны, так и международных спонсоров. Для нас — обогащением дизайна, технологиями и компетенциями, для них — более низкими затратами в сопоставлении с КИ в США и Западной Европе. Некоторые эксперты утверждают, что по сравнению с США российские сайты предлагали спонсорам 30–60% экономии в зависимости от сложности исследования, специфики процедур, контингента пациентов и т.д. на уровне качества не ниже, чем таковые КИ в Западной Европе и Северной Америке.[3]
Кроме того, привлекательность площадок России опирается на компетенции испытателей, подготовленность клинических баз, акцептирование актуального дизайна, и, не в последнюю очередь, сходство генетической демографии (включая близкие стереотипы питания) населения (испытуемых) с таковым США (Северной Америки) и Западной Европы — наиболее платежеспособных спонсоров, что позволяет адекватно переносить полученные результаты на страны этих регионов.
Не следует забывать, что монетизированная ценность КИ в общем бюджете НИОКР одного нового ЛП составляет сегодня 50–58%%, — причина неослабевающего финансового интереса спонсоров КИ БФФ к российскому направлению.[4]
Россия стала не только популярной площадкой для глобальных КИ (особенно фазы III), но также вошла в четверку важнейших и наиболее полных адресов поисков баз и результатов КИ в мире — на русском языке официальный реестр Минздрава России, на английском — www.clinicaltrials.gov, сайт международного реестра КИ Национальных институтов здоровья США (National Institutes of Health, NIH); Clinicaltrialsregister.eu, сайт ЕС и apps.who.int/trialsearch, сайт ВОЗ.
Тот факт, что крупные фармацевтические производители решили испытывать новые молекулы в России — лучшее доказательство их доверия и приверженности рынку КИ в России, важный признак его благоприятных перспектив, не утраченных и сегодня.
Клинические испытания — испытания санкциями
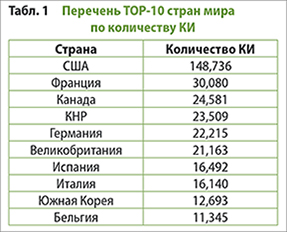
Мировой опыт проведения КИ беспрецедентен — это сотни тыс. исследований: только первая десятка ведущих стран БФФ за период 2008-2023 гг. выполнила 326954 (!) КИ, что иллюстрируется следующим перечнем.[5]
Что такое эти сотни тысяч проведенных КИ? Это сотни тысяч заявок–обоснований, разрешений, технологий (дизайнов схем лечения, электронных дневников, анкет–опросников, онлайн–коммуникаций и пр.), рецензируемых протоколов, пациентов–испытателей с доступом к инновационной фармакотерапии, это дорога в будущее отрасли, без которого человечество обречено, даже если ему удастся избежать мировой войны. Это основа КИ БФФ 3.0, когда научные подходы, технологии и инструментарий будут другими, отличными от нынешних.
До 2022 г. Россия входила в первую тройку стран–лидеров по набору пациентов для исследований, занимая 11-е место на рынке КИ с долей 2,44% в мире, имея около 900 площадок, причем большинство исследований приходилось на важнейший раздел медицины — онкологию (288 КИ), далее шли заболевания ЦНС (36) и инфекции (34).[6]
В числе TOP–10 БФФ с наибольшим количеством проводимых КИ с площадками для набора в нашей стране — Bristol Myers Squibb (BMS), GlaxoSmithKline (GSK), Johnson & Johnson (J&J), Merck, Novartis, Novo Nordisk, Pfizer, Roche, AstraZeneca, Sanofi.[7]
Не сомневаюсь, что перечисленные "гранды", как и подавляющее число их последователей, покидают Россию не от хорошей жизни и наверняка с грустью в сердце: судьбы пациентов, колоссальные интеллектуальные и материальные затраты, надлежащий подбор испытателей, многолетние связи с компетентными российскими коллегами, широкий реестр уже полученных данных, налаженный контроль, отсутствие ясности с переносом исследований на другие площадки — все это приходится оставлять отнюдь не по "медицинским" показаниям, а в угоду примитивной геополитике, далекой от медицины.
Из 1233 инновационных КИ, действовавших в России в начале февраля 2023-го, 1135 (91,6%) проводились 100 компаниями БФФ, из более 10 тыс. активных сайтов 9193 (90,2%) принадлежали этим компаниям.[8]
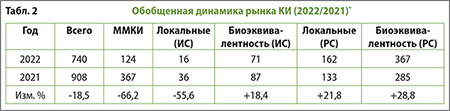
По данным исследовательского сайта, наблюдается уменьшение количества выданных разрешений на проведение клинических исследований по сравнению с 2021 г.: отрицательный рост составляет примерно 18,5% (табл. 2).
где:
- ММКИ – международные многоцентровые КИ;
- ИС – иностранные спонсоры;
- РС – российские спонсоры.
----
*Данные с сайта АОКИ (Информационно-аналитический бюллетень №26, 2023: Итоги 2022)
Отмечено уменьшение количества ММКИ: разрешения на их проведение в 2022 г. выдавались на 66% реже, одновременно выросла доля локальных КИ. Увеличилось число разрешений на проведение исследований биоэквивалентности: данная тенденция сохранилась с 2021 г. (тогда рост числа выданных разрешений составил 46,6% г/г) именно в разрезе отечественных производителей.
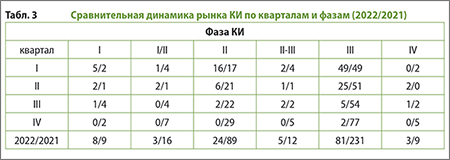
Сравнительная динамика рынка КИ 2022/2021 гг. по кварталам и фазам, представлена в табл. 3, составленной по данным Ассоциации организаций по клиническим исследованиям (АОКИ).[9]
По сравнению с 2021 г. наметилась выраженная тенденция к снижению числа исследований II и III фазы в общем объеме КИ (снижение на 73% и 65% соответственно). При этом количество выданных разрешений на проведение КИ I фазы снизилось незначительно, что позволяет надеяться на продолжение КИ в 2023-2024 гг.
По мнению АОКИ, отказ большинства международных спонсоров от запуска новых ММКИ означает, что в реальности состоятся далеко не все исследования, одобренные регулятором. АОКИ получила информацию о судьбе 89 разрешений из 124 ММКИ: из этих 89 почти половина (43 исследования) прекращены, а около трети тех, чья судьба известна (30 проектов), спонсоры пока держат "на паузе". Стартовали лишь 14 международных исследований, высока вероятность запуска еще двух.[10]
Потеря российского рынка КИ создала непростые проблемы обеим сторонам этого важнейшего направления медико-фармацевтической деятельности.
----
[1] http://acto-russia.org/en/index.php?option=com_content&task=view&id=65
[2] https://www.mos.ru/city/projects/clinicaltrials/
[3] https://credevo.com/articles/2018/07/30/russia-clinical-trial-regulatory-process/
[4] https://www.frontiersin.org/articles/10.3389/fmed.2021.760762/full
[5] (https://www.pharma-iq.com/pre-clinical-discovery-and-development/articles/top-five-countries-running-the-most-clinical-trials
[6] https://www.clinicaltrialsarena.com/special-focus/ukraine-crisis/clinical-trials-in-russia-big-pharma-makes-moves/
[7] Топ-10 создан на базе данных клинических испытаний GlobalData
[8] https://www.clinicalleader.com/doc/the-impact-of-the-russia-ukraine-war-on-clinical-trials-0001
[9] http://acto-russia.org/index.php?option=com_content&task=view&id=137
[10] http://acto-russia.org/files/bulletin_26.pdf