Роль искусственного интеллекта в клинических исследованиях
ч. 1 Искусственный интеллект (ИИ) — это область информатики, связанная с разработкой интеллектуальных компьютерных систем, т.е. виртуальных пространств, обладающих возможностями человеческого разума. Другими словами — это наука о том, как научить компьютеры делать что–то сопоставимое с нами, например, решать логические задачи, причем не менее успешно.
Гандель Виктор Генрихович
Член–корр. Международной академии интеграции науки и бизнеса (МАИНБ), к.фарм.н.
Генеративная система ИИ — это обученный ИИ, способный использовать и создавать коммуникативную реальность (контент) в формате текстовых, аудиальных, лингвистических, пространственных и визуальных ресурсов, или модусов (мультимодальность).
Финансовые аналитики Blumberg Intelligence прогнозируют общий оборот рынка генеративного ИИ к 2032 г. в 1,3 трлн. долл.: в сравнении с текущими объемами он возрастет примерно в 30 (!) раз.[1] Экономический потенциал генеративного ИИ для бизнеса консалтинговая компания McKinsey оценивает значительно выше — от 2,6 трлн. до 4,4 трлн. долл. ежегодно в 63 проанализированных областях использования.[2] Посмотрим, кто из них окажется ближе к истине.
Представление о рынке ИИ в рамках наук о жизни к концу текущего десятилетия выглядит следующим образом: здравоохранение в целом — 70 млрд.[3], медицина (медицинская визуализация и диагностика, планирование терапии и персонализированная медицина, рабочий процесс больницы, носимые устройства, виртуальные помощники и пр.) — 26 млрд.[4],[5], фармация (драг–дизайн[6], оптово–розничный сектор, персонализированная фармация) — 27 млрд.[7], закупки устройств и программ, администрирование, техобслуживание и пр. — 3-5 млрд., машинное обучение (МО), консалтинг — 7-10 млрд.
Согласно последнему опросу McKinsey (22 февраля 2023-го), ИИ способен повысить эффективность бизнеса до 40% и снизить операционные расходы до 30%.[8]
Возможности ИИ формируются путем внешнего обучения или самообучения на основе целевого набора данных МО и зависят от модальности или типа используемого набора. ИИ "реализуется" в виде программного обеспечения, которое может запускаться на компьютерах, серверах или в виде чипов (на чипе).
"Мозг" ИИ — это графические процессоры Nvidia, микросхемы компьютерных гигантов Apple, Intel, Google, AMD, IBM, Amazon, Microsoft, Cerebras, SambaNova, Untether и др., всего более 3 тыс. компаний. Контрактное производство многих из них сосредоточено в тайваньской компании полупроводников (Taiwan semiconductor manufacturing Co., TSMC), занимающейся изучением и созданием всех передовых микросхем ИИ в мире.
Эксперты считают TSMC важнейшей инновационной компанией планеты. Ее рыночная капитализация составляет сегодня около полутриллиона долларов. Это одна из 15 самых ценных компаний в мире, она стоит больше, чем "банк банков" JPMorgan Chase или "супермаркет супермаркетов" Walmart вместе взятые.[9]
Не отстает и чипмейкер Nvidia: сегодня она входит в пятерку компаний с рыночной капитализацией каждой из них в 1 трлн. долл. — Apple, Microsoft, Alphabet (структура Google) и Amazon.
Гендиректор Nvidia, американский бизнесмен тайваньского происхождения Дженсен Хуанг (Jensen Huang), не оставил сомнений в том, насколько важна TSMC для будущего ИИ, произнеся: "По сути, есть воздух — и есть TSMC".[10]
Суперчип с ИИ под названием Nvidia A100 недавно создан в центе Intel в Хайфе (Израиль) — один из лучших на сегодня по соотношению производительность/потребление энергии для высоких рабочих нагрузок дата-центров. Благодаря новой архитектуре графического 4–нанометрового процессора с 80 млрд. транзисторов, чип может обеспечить до 4000 терафлопс вычислительной мощности (1 терафлопс равен 1 трлн. операций в секунду).[11]
Одни из последних схожих продуктов Apple — 5-нм процессоры M2 Pro (до 12 ядер CPU, 19 ГБ) и M2 Max (до 38 ядер GPU, 96 ГБ).
Apple, созданная Стивом Джобсом и Стивом Возняком в 1976 г. в заброшенном гараже с начальным капиталом в 2 тыс. долл., стала первой в мире компанией, стоимость которой после закрытия фондовых рынков США 31 июля с.г. превысила 3 трлн. долл., что сделало ее крупнейшим бизнесом в мире.[12]
Одна из технологий реализации ИИ — нейронные сети (НС). НС — это подмножество искусственного интеллекта, моделирующего структуру человеческого мозга для обработки сложных наборов данных. Представляют собой базовую алгоритмическую архитектуру, лежащую в основе всех важных прорывов в области искусственного интеллекта за последнее десятилетие — от AlphaGo и AlphaFold до Midjourney, GitHub Copilot, Stable Diffusion и ChatGPT на чипах.
Преимущества применения ИИ в фармации
ИИ в фармации признан инновационным способом (стартапом) оптимизированной разработки лекарств, ориентированным на минимум затрат (инвестиционных, временных, материальных, интеллектуальных и пр.) при максимуме искомого результата на выходе. Простыми словами, в заданном пространстве ИИ выдает целевой результат, избегая любых наших с вами "заморочек".
Эксперты формулируют 6 главных преимуществ применения ИИ в клинических исследованиях (КИ)[13] :
- Ускорение вывода на рынок.
- Снижение затрат.
- Оптимизация анализа данных.
- Персонализация.
- Улучшение результатов лечения.
- Доступ к экспертизе в режиме реального времени.
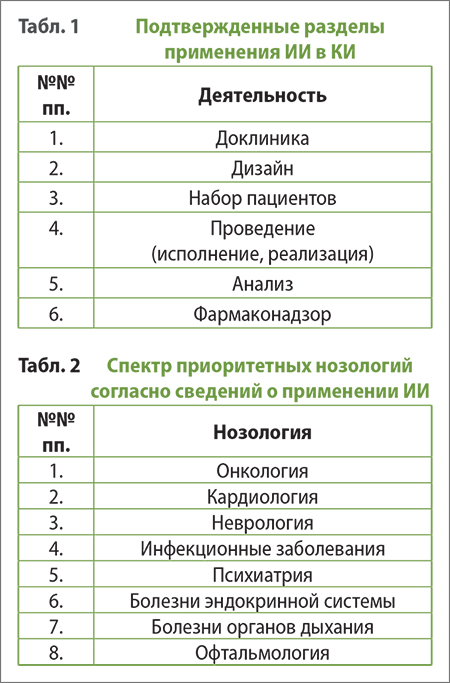
Указанные ценности ИИ реализуются в следующих разделах КИ:
- Набор пациентов и скрининг.
- Тестовый дизайн и оптимизация.
- Сбор и анализ данных.
- Прогностическое моделирование.
- Обнаружение побочных эффектов (нежелательных явлений).
В апреле 2021-го британская Exscientia и германская Evotec объявили о первой иммуноонкологической (ИО) молекуле, созданной с помощью ИИ, ознаменовавшей новый подход к терапии рака путем стимуляции собственной иммунной системы пациента.[14]
Возможность создавать терапевтические антитела в парадигме in silico de novoспособна сократить время проведения КИ новых потенциальных кандидатов с пяти-шести лет до 18-24 месяцев, увеличить вероятность их успешного исхода. Указанный стартап является инновационным шагом вперед, открывающим потенциал для предоставления революционных терапевтических средств одним нажатием кнопки для каждого конкретного пациента.[15]
In silico de novo — современная технология компьютерного биомолекулярного моделирования структуры и функции "движением" от простого к сложному.[16]
Молекулярное моделирование легло в основу проекта модернизации FDA 2.0 американского сенатора Рэнда Пола от января 2023 г., спонсировавшего закон о проведении доклиники, положившего конец "страданиям и смерти подопытных животных и ускорившего вывод на рынок безопасных и эффективных лекарств путем сокращения бюрократической волокиты, не поддерживаемой современной наукой".[17]
Защитник животных, 20-летняя экоактивистка Грета Тунберг, номинированная в 2019 г. на Нобелевскую премию, в восторге.
В июле 2021 г. система ИИ DeepMind под названием AlphaFold предсказала белковые структуры 330 тыс. белков, включая все 20 тыс. белков генома человека. Эта база данных расширилась и ныне включает более 200 млн. белков, охватывая практически все известные науке каталогизированные белки.
В феврале 2022 г. биотехнологическая компания Insilico Medicine (расположена в медцентре новых технологий университета Джонса Хопкинса в США, зарегистрирована в Гонконге) во главе с ее основателем и гендиректором 44–летним Алексом Жаворонковым (ранее аспирантом физфака МГУ), сообщила о начале фазы I КИ обнаруженной ИИ молекулы–кандидата на лечение идиопатического легочного фиброза (ИЛФ), — неизмеримо быстрее и дешевле традиционных доклинических программ.[18]
В феврале 2023 г. FDA присвоило первое обозначение орфанного препарата фармакологическому кандидату компании Insilico Medicine: начало глобального исследования фазы II продукта планируется в текущем году.
Компания объединила две бизнес–модели: предоставление услуг и программное обеспечение по поиску лекарств на основе ИИ через свою платформу Pharma.AI (www.insilico.com/platform/) и разработку собственного набора доклинических программ.
На начало этого года "биотехи", использующие ИИ, создали более 150 низкомолекулярных кандидатов на стадии открытия и более 15 готовых к КИ.[19] Впереди — неизведанный и необъятный путь к большим библиотекам молекул–кандидатов.
----
ИИ — выдающийся интеллектуальный резерв фармации и медицины, превращающий научные достижения в производительные силы общества, в нашем случае — в экосистему терапевтического сопровождения жизнедеятельности индивидуума, от зачатия до глубокой старости и исхода.
----
ИИ как новейшая область информатики фактически стала сетевой историей: возникли прямые коллаборации ученых — новый кейс XXI в. Именно здесь рождаются прорывные идеи — в медицине и фармации в особенности.
В КИ искусственный интеллект способен (и предназначен для этого!) генерировать продвинутый дизайн, разрабатывая новые клинические решения, оптимизируя существующие подходы и снимая устаревшие процедуры. Для виртуальных КИ — это как раз то, что так необходимо сегодня и без чего точно не обойтись завтра.
Опасения, что внедрение ИИ приведет к массовой потере рабочих мест персонала КИ, несостоятельны, наоборот — он потребует бóльших знаний, приведет к появлению новых компетенций и технологий, улучшит медфармобразование, кардинально изменит отношение общества к медицине и фармации вообще и к здравоохранению в частности. И к состоянию собственного здоровья – в первую очередь.
Потенциал ИИ при проведении исследований
-
Доклиника
Закон о модернизации FDA 2.0 может надолго, если не навсегда, изменить алгоритм разработки лекарств. Теперь для одобрения FDA больше не требуется доклинических испытаний фармакологических кандидатов на "неподходящих" животных. Закон оснащает исследователя бóльшим числом инструментов "упрощения" доклиники и сокращением времени получения требуемых подтверждений: это модели in vitro, in silico, химтестирование и гуманизированные модели мышей там, где этого требует моделирование эксперимента на "человеческих" генах, клетках, тканях и органах (например, при иммуноонкологических, инфекционных, воспалительных заболеваниях, болезнях печени и пр.).
Сегодня исследуется масса фармакологических кандидатов, где просто нет валидной животной модели для испытаний: мы не можем использовать мышей или приматов в подобных схемах дизайна КИ.
Важнейшее значение приобретает доступ к данным по фармакокинетике (ФК) и фармакодинамике (ФД) предыдущей доклиники и КИ (в т.ч. неудачных, обнаруживших соединения с высоким риском и пр.), что необходимо для разработки и обучения эффективных и надежных алгоритмов ИИ, генерирующих новые стабильные молекулы с предполагаемым терапевтическим потенциалом и минимумом токсичности. Отсутствие соответствующих опубликованных данных по причинам защиты конкуренции или собственности является сегодня серьезным препятствием для раскрытия потенциала ИИ в создании новых лекарств.
Разработанное ПО прогнозирования токсичности на основе многомерной линейной регрессии количественного соотношения структура/активность (quantitative structure–activity relationship, QSAR) позволяет лучше ориентироваться в проблемах зависимости фармакологической активности и токсичности от химических или структурных характеристик молекулы–кандидата.[20]
Как и в других областях применения ИИ, интерпретация моделей может быть сложной с учетом высокого уровня неопределенности на ранних этапах исследований. Понимание особенностей модели и лежащих в ее основе биологических механизмов является ключом к интерпретируемости и уверенности в прогнозах.
Начало широкого "вторжения" ИИ в планирование драг–дизайна положено.
----
Главное сегодня — умение руководителя фармбизнеса решить для себя и коллег принципиальный вопрос: где следует применить ИИ, а где — подождать.
----
Прогнозирование вероятных клинических исходов — вот главное, что возлагается на ИИ при проведении КИ сегодня. Уверенность в способности ИИ реализовать эту функцию способствует более широкому внедрению метода, что особенно важно для появления прецизионной медицины и нивелирования (устранения) возможных статистических изменчивостей в генеральной совокупности, что обычно не исключено. Использование алгоритма ИИ для прогнозирования исходов и выявления участников, скорее всего, будет лучше "прогрессировать" и быстрее достигать конечных точек, что может привести к сокращению сроков испытаний.
При анализе большой массы электронных медицинских карт, что практически неисполнимо человеком, ИИ дает возможность прогнозировать вероятность отказа от КИ по показаниям здоровья пациентов. С целью исключения нежелательного потенциального отсева (в С/С патологии в особенности), ИИ позволяет нацелить этих конкретных "проблемных" участников на получение дополнительного "образования", чтобы стимулировать их более длительное участие в испытаниях. Подобные инструменты дают возможность оптимизировать общий размер выборки путем сохранения участников и отказа от дополнительного найма (сохраняют время и деньги).
ИИ облегчает проведение всестороннего статистического анализа и решает сложные проблемы отсутствия данных и пропусков посещений, что особенно важно во время чрезвычайной ситуации в области общественного здравоохранения, как, например, вызванной COVID–19.
Особое внимание привлекают алгоритмы МО, позволяющие прогнозировать клинические исходы, стратифицированные (по субпопуляциям) в соответствии с экологическими и генетическими атрибутами. На основании Больших (медико–биологических) данных из интервенционных испытаний со сведениями о выживаемости без прогрессирования и оценки общей выживаемости, упорядоченным по молекулярным профилям опухолей, удалось в ряде КИ снизить смертность от рака на 15–25%, что позволяет отнести подобную модель к успешным клиническим исходам.[21]
В онкологии эти инструменты МО могут быть реализованы для улучшения выбора и адаптации исследуемых препаратов к особенностям гистологии конкретного вида рака, что способствует увеличению выживаемости. Достижения в указанной области еще только предстоят, однако с моделями МО, включающими исчерпывающие данные из соответствующих мультиомических признаков (биомаркеров), связывают потенциал изменения парадигмы лечения и пересмотра способа разработки и набора прецизионных испытаний.
Онкология — это та область, где надежды на построение оптимальной программы исцеления — от дизайна до плановой терапии, связывают именно с ИИ. Особенно перспективно его применение в испытаниях in-silico с использованием клинических данных для формирования когорт, моделирующих эффективность лечения.[22] Тем не менее, проблема недостаточности доступных доброкачественных, проверенных и полных наборов данных пока ограничивает потенциал применения ИИ в этом направлении.
На ранних этапах КИ инструменты ИИ можно использовать для прогнозирования биодоступности и токсичности, молекулярных характеристик, чувствительности к мишеням, а также снижения числа неудачных испытаний на более поздних стадиях, в особенности при планировании фаз II/III, увеличивая вероятность одобрение заявки регулирующими органами.
Продвинутые инструменты ИИ глубокого МО с доступом к достаточному количеству позитивных данных позволяют полностью заменить группу плацебо виртуальной контрольной группой, состоящей исключительно из синтетических данных, прогнозировать прогресс заболевания в ней. При этом ожидается ряд преимуществ, в т.ч. сокращение бюджета, снижение нагрузки на сайт и пациентов и, возможно, более быстрое проведение КИ.[23] Это особенно эффективно в случаях исследования орфанных заболеваний, ограниченности времени, бюджета и пр.
Модели МО, формирующие дизайн КИ на основе Больших данных медико–биологических характеристик пациентов, могут использоваться не только для прогнозирования шансов одобрения регулирующими органами, но и для оценки вероятности успеха при переходах фаза/фаза.
Понимание факторов, воздействующих на успех или неудачу конкретной фазы (сложность протокола, выбор клинических конечных точек, критериев приемлемости, группы вмешательства и пр.), влияет на дизайн исследования текущей и последующих фаз. Построение аналогичных моделей, основанных на оценках риска возникновения нежелательных эффектов или отсутствия эффективности, представленных в литературе, помогает в разработке испытаний, гарантирующих оптимум благополучия и безопасность участников.
Наконец, ИИ помогает нивелировать этические проблемы КИ путем непредвзятой защиты от неправомерного использования медицинской информации.
Конкретные инструменты ИИ в КИ в формате специализированных платформ находят все большее применение в современном драг–дизайне не только крупнейших игроков БФФ, но и компаний т.н. второго эшелона, стремящихся нарастить свой научный потенциал до уровня постоянно ужесточающихся требований высококонкурентного фармрынка, на котором инноваторы окажутся в выигрыше (и выживут) раньше, чем это удастся сделать остальным.