Суверенизация фармации — плюсы и минусы (ч. 6)
Февраль 2022-го стал для клинических исследований Большой Финансовой Фармы рубежом, заставившим взглянуть на медико-фармацевтический ландшафт с позиций геополитического, экономического и социокультурного реализма, чего, говоря откровенно, не наблюдалось давно.
Гандель Виктор Генрихович
Член-корр. Международной академии интеграции науки и бизнеса (МАИНБ), к.фарм.н.
"Недовольство собою есть необходимое условие разумной жизни.
Только это недовольство побуждает к работе над собою"
Лев Толстой, русский писатель
На треке клинических испытаний: потери БФФ
Ситуацию адекватно обрисовал американский финансист, председатель и главный исполнительный директор американской транснациональной корпорации по управлению инвестициями BlackRock, одной из крупнейших инвесткомпаний мира с активами 8,6 (!) трлн. долл. Ларри Финк (Лоуренс Дуглас Финк, Laurence Douglas Fink). В письме акционерам он оценил события этого месяца как "конец глобализации, которую мы пережили за последние три десятилетия".[1] Одним из фундаментальных последствий демонтажа глобализации, повлиявшим на инфраструктуру клинических испытаний (КИ) в целом, стало снижение способности Большой Финансовой Фармы (БФФ) продвигать перспективные кандидаты на лекарства.
КИ фармакологических кандидатов, которые впоследствии в форме лекпрепаратов планируется ввести в гражданский оборот, проводятся в разных странах. Большинство из многих тысяч участников глобальных КИ фазы III, предназначенных для доказательства безопасности и эффективности кандидатов, сегодня регистрируются в центрах, расположенных в странах Восточной Европы. Причин тому немало: оптимизация стоимости, бóльшие возможности набора заинтересованных пациентов, перспективы регистрации потенциального ЛП в регионе проведения КИ и пр.
В число стран, внесших существенный вклад в набор пациентов–европеоидов, включенных в глобальные КИ, стали Украина и Россия. Украина надолго выбыла из процесса, поэтому как база КИ пока упоминаться не будет.
Ликвидация или убыточное для БФФ уменьшение российского рынка КИ создали ряд институциональных проблем, таких как:
- утрата возможности набора новых пациентов и неопределенность с уже рекрутированными;
- пересмотр логистики центральных складов материально–технического снабжения;
- приобретение и распределение средств информационной поддержки (пособия, инструкции, листы–опросники, операционные процедуры, медицинские дневники и пр.);
- логистика биообразцов (центры лабораторной диагностики);
- ревизия центров компетенций — инфраструктуры КИ и стоимости персонала, включая координаторов и обученных наблюдателей исследований, независимых аудиторов, порталы поставщиков и иных электронных ресурсов;
- переоценка производительности сайтов с учетом их высокой отдачи в России;
- пересмотр бюджетов мониторинга, пациентозатрат и допрасходов с перспективами их неизбежного роста.
КИ в Центральной и Восточной Европе
С учетом изложенного, более приемлемыми для реализации сохранившихся и высвободившихся мощностей КИ БФФ были назначены страны Центральной и Восточной Европы — Польша, Чехия, Венгрия, Словакия, Хорватия, Сербия, Болгария, Румыния, Латвия, Литва и Эстония (далее — ЦВЕ). С момента принятия в 1997 г. стандарта ICH–GCP данный регион из менее 1% мировой доли КИ превратился в мощный центр исследований, занявший во втором десятилетии XXI века более 13% рынка инновационных фармакологических кандидатов и лекарственных продуктов. Кроме того, что важно, эти страны вкупе располагают соразмерными с Россией возможностями замены подверженного риску конвейера КИ по следующим причинам:
- СВО пока особо не повлияла на здравоохранение указанных стран, сохранивших стабильную работу больниц, компетентный персонал, логистику поставок и возможности мониторинга КИ;
- большинство многонациональных КИ, действовавших или планировавшихся в России, так или иначе, охватывало страны ЦВЕ, что позволяло увеличить набор пациентов в уже существующие центры или добавить новые центры.
Еще одно объяснение заключается в том, что пациенты в Западной Европе имеют больший доступ к ЛП по схемам лекстрахования, поэтому их сложнее убедить принять участие в КИ ввиду 50–процентной вероятности получения плацебо. Напротив, пациенты стран Восточной Европы, не имея подобных преференций, охотнее принимают участие в КИ ввиду тех самых 50% шансов на получение активного фармакологического кандидата — т.е. на реальное лечение.
Тем не менее, согласно данным Clinical Trials Arena — ведущего источника публикаций СМИ об активности конвейера КИ, последний застопорился не только в России, но и в соседних Польше, Чехии и Венгрии, ввиду очевидных экономических проблем в этих странах.[2]
В создавшихся условиях Хельсинская декларация требует от спонсоров КИ исполнить свои обязательства перед включенными в испытания пациентами в отношении их лечения, предоставив одобренную современную схему терапии с лекарственной поддержкой.
Независимые наблюдатели отмечают высокую активность региона ЦВЕ из–за намерений сохранить конвейер КИ как привлекательный с финансовой и научной стороны.
Приведенные примеры демонстрируют приостановку, а в ряде случаев и блокировку конвейера КИ, следствием которых становится неопределенность с поступлением фармакологических кандидатов на финишный этап создания ЛП, заморозка уже потраченных средств и усилий, неудовлетворенность пациентского сообщества консервацией разработок ожидаемых лекарств на дорыночной стадии с неясными перспективами.
БФФ, тем не менее, намерена развиваться: финансовую и имиджевую мотивированность никто не отменял. Рассмотрим вероятные направления ее рыночного поведения в условиях нарастающих ограничений, в т.ч. регуляторных и геополитических, за пределами рынка ЦВЕ.
КИ в Западной Европе
Это единственный, отличный от ЦВЕ регион, отвечающий критериям географической близости логистических маршрутов поддержки КИ. С точки зрения пропускной способности сегодня растут лишь несколько западноевропейских рынков (в первую очередь, Испании и Португалии), поэтому большинство из них пока не "перегреты" и способны взять на себя дополнительную нагрузку на конвейере КИ. Германия, например, с 2014 г. постепенно теряет долю на мировом рынке КИ и, похоже, также готова взять на себя дополнительную работу. Однако разница в затратах по сравнению с Россией здесь выше, чем в ЦВЕ, при одновременно более низкой производительности центров, поэтому переход к данному варианту переноса КИ определенно приведет к перерасходу бюджета, выделяемого на них.
Еще одним фактором, работающим против Западной Европы, является хроническая нехватка сотрудников по КИ (Clinical Research Associate, CRA), особенно в крупных странах, какими являются Франция, Великобритания и Германия. CRA, нередко называемые клиническими мониторами или наблюдателями за испытаниями, по существу являются медицинскими функционерами, выполняющими множество видов деятельности, связанных с медицинскими исследованиями, включая КИ, особенно с приобретением мирового опыта.
КИ в Северной Америке
Многое из того, что было сказано о Западной Европе, применимо и к Северной Америке (стоимость, производительность, нехватка CRA). Кроме того, давнее отсутствие синергии логистических маршрутов делает данный регион весьма спорным для перераспределения КИ.
КИ в странах Глобального Юга
Изучая маршруты продолжения начатых КИ и старта новых, логично обратить взор на страны Глобального Юга (Латинская Америка, Африка, Азия и Океания), где проживает 85% не самого богатого населения планеты и куда рекомендуют перемещаться ВОЗ и ООН. Однако для БФФ здесь кроется одно большое "но" — отдаленное от населения "золотого миллиарда" генетико–демографическое разнообразие в популяциях, не позволяющее экстраполировать результаты КИ на население богатых стран, в основной массе европеоидов.
Так, к примеру, FDA в 2022 г. отклонила заявку китайской компании Innovent Biologics на регистрацию Синтилимаба (Cintilimab) — моноклонального антитела к PD-1, одобренного в Китае для иммунотерапии немелкоклеточного рака легкого (НМРЛ), проголосовав 14 голосами против 1 за предоставление дополнительных данных, подтверждающих возможность взаимодействия PD-1/PD-L1 как фактора отрицательной регуляции иммунной системы в американской популяции.[5]
Регистрация Синтилимаба была подтверждена FDA лишь в апреле 2023 г.[6]
Аналогичная участь постигла другой китайский препарат Сульфатиниб (Sulfatinib) — пероральный ингибитор тирозинкиназы, разработанный компанией Hutchison, одной из крупнейших корпораций гонконгского списка Fortune 500 (121 млрд. долл.), одобренный в Китае в 2020–2021 гг. для лечения распространенных непанкреатических нейроэндокринных опухолей.
Не будем специально акцентировать внимание на непростых взаимоотношениях FDA и ее китайской "сестры", да и в целом их руководящих патронов.
С целью предотвращения подобных коллизий FDA рекомендует проводить КИ препаратов в различных расовых и этнических группах населения для выявления их эффективности, максимально точной переносимости и возможных побочных эффектов. В настоящее время, по данным FDA, 75% участников КИ являются белыми, 11% — латиноамериканцами и лишь менее 10% — африканцами и азиатами.[7]
Поскольку общедоступная информация в реестрах испытаний во многом зависит от своевременности обновлений, предоставляемых спонсорами, Clinical Trials Arena обратилась к ним с рекомендацией комментировать запланированные испытания с точным указанием места их проведения.
Анализируя отчет о глобальном рынке КИ и его перспективах (2023-2028гг.), исполненный маркетинговым агентство researchandmarkets.com, проведем краткий обзор возможных мест (регионов) переноса приостановленных и несостоявшихся КИ с учетом предложенных рекомендаций.[8],[9]
-
КИ в Латинской Америке
Более выгодна по стоимости и производительности испытательных площадок, однако дополнительные мощности здесь могут стать проблемой ввиду уже состоявшегося роста инновационных КИ в период 2016-2021 гг. (с 3,8% мировой доли в 2016 г. до 4,1% в 2021 г.). Таким образом, прирост глобального конвейера в этом регионе пока проблематичен с учетом расово–генетической составляющей команд испытуемых плюс хроническое отсутствие синергии логистических маршрутов.
-
КИ в Юго–Восточной Азии
Китай и Южная Корея (частично Индия), учитывая объем и разнообразие популяционных характеристик, становятся ведущими странами по мировому росту КИ, что является отражением изменения баланса глобального отраслевого портфеля КИ в направлении поддержки этой перспективной локации фармотрасли, поэтому возможности дополнительного прироста здесь пока ограничены, учитывая перегруженность логистических маршрутов и некоторые проблемы с их синергией. Гипотетическим затруднением может стать также возможное недопонимание между местными регуляторами с одной стороны и FDA, европейской EMA и британской MHRA — с другой.
-
КИ на Ближнем Востоке и в Африке
Пропускная способность данного региона, даже при наличии определенной синергии логистических маршрутов, весьма ограничена, поэтому перенаправление совмещенного российско–украинского конвейера КИ, на порядок превышающий реальные возможности местных площадок, представляется пока нереальным.
Разнообразие пациентов
Спонсоры КИ стали учитывать рекомендации FDA, сделанные в опубликованном в апреле 2022-го проекте руководства "Планы разнообразия для улучшения набора участников из недостаточно представленных расовых и этнических подгрупп в клинические испытания" (Diversity plans to improve enrollment of participants from underrepresented racial and ethnic populations in clinical trials guidance for industry, DRAFT GUIDANCE). Теперь бóльшее внимание уделяется перераспределению центров и пациентов из России как нейтральному шагу с позиций разнообразия пациентов со сходным "этническим следом".[10]
Таким образом, регион ЦВЕ, по–видимому, продолжает оставаться местом, более подготовленным для принятия ответственности за приостановленный в России конвейер КИ, поскольку обладает необходимой мощностью, предлагает сопоставимые затраты и производительность площадок, гарантирует надлежащее качество мониторинга исследований и аудита, а также обеспечивает географическую близость участников — комфортную логистику. Перспектива восстановления привлекательного российского рынка КИ также отнюдь не утрачена.
Завершая обзор ситуации, созданной нашими западными "партнерами" в области КИ, можно сделать заключение: понятие diversification превратилось практически в свою противоположность — deworsification (игра слов, означающая, что нарушенная диверсификация ситуацию лишь ухудшает).[11]
Перспективы развития БФФ — ближайшие, среднесрочные и отдаленные, в т.ч. по разделу КИ, очевидно, столкнулись с дилеммой: как и куда двигаться дальше так, чтобы финансовые интересы "правообладателей" не пострадали, а население не осталось без инновационных препаратов, становящихся блокбастерами. Задача не из простых, скажем прямо.
УТРАТЫ БФФ
Объективно оценим ситуацию с прекращением (приостановкой) КИ в России. Их "заморозка", фазы III в особенности, создает серьезные проблемы спонсорам: потеря вложенных средств, компенсации пациентам, разрушение архитектоники дизайна, вероятная утрата отчетов, протоколов, медкарт и другой регистрационной документации, остановка планового движения в направлении регистрации, нарушение связей с российскими коллегами и КРС, играющей важную роль в продвижении ЛП в стране и ожидаемом коммерческом успехе — всего не перечислишь, многое проявится позднее.
Отдельная статья — приостановка работы или закрытие активных сайтов как площадки обсуждений, рецензирования и аудита, отказ от публикаций компетентных российских коллег в "западной" клинической периодике, ограничивающий ареал профессионального общения на европейском треке КИ, где сегодня преобладают американские публикации и "наступают" китайские, индийские и другие "азиатские".
Тем не менее, утраты БФФ хоть и существенны, но не критичны: они нивелируются бóльшими инвестициями, релокацией приостановленных КИ, пролонгацией периодов их выхода на регистрацию и далее в гражданский оборот с урезанной маржой.
Каковы промежуточные выводы "на сейчас"? Промежуточные — потому, что до окончательных и обоснованных заключений фактологически еще далеко. Прежде надо уяснить, какое воздействие на КИ оказала "прошедшая" пандемия COVID–19 и как на них может повлиять ИИ, активно вторгающийся в медико–фармацевтические технологии.
Оба обстоятельства способны оказать влияние не только на НИОКР и их важнейшую составляющую — КИ, но и коренным образом изменить само существо медико–фармацевтической разработки лекарственного пособия XXI в. как цивилизационной составляющей науки о жизни в ее философской интерпретации.
---
[1] https://www.blackrock.com/corporate/investor-relations/larry-fink-chairmans-letter
[2] https://www.clinicaltrialsarena.com/features/ukraine-russia-clinical-trials/
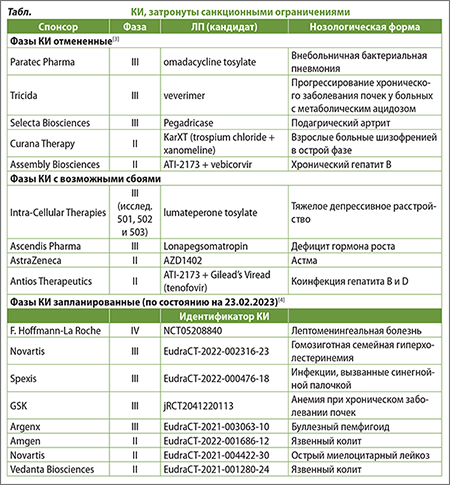
[3] в табл. https://www.clinicaltrialsarena.com/special-focus/ukraine-crisis/clinical-trials-in-russia-big-pharma-makes-moves/
[4] в табл. https://www.clinicaltrialsarena.com/features/ukraine-russia-clinical-trials/
[5] https://www.echemi.com/cms/1187819.html
[6] https://ichgcp.net/ru/clinical-trials-registry/NCT05803928
[7] https://vademec.ru/news/2023/01/12/v-ssha-otmenili-obyazatelnoe-predostavlenie-rezultatov-doklinicheskikh-issledovaniy/
[8] https://www.researchandmarkets.com/reports/5754834/global-clinical-trials-market-study-phases
[9] https://www.researchandmarkets.com/reports/5754834/global-clinical-trials-market-study-phases
[10] https://www.fda.gov/regulatory-information/search-fda-guidance-documents/diversity-plans-improve-enrollment-participants-underrepresented-racial-and-ethnic-populations
[11] Deworsification – бизнес-термин, означающий возрастание риска падения доходности при неправомерном вторжении в логистику